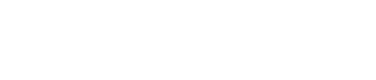MK体育平台腦科學轉化研究院彭勃課題組🫳🏽、MK体育平台附屬華山醫院毛穎課題組和上海市精神衛生中心袁逖飛課題組的研究人員開展的聯合攻關🧖🏻,利用活細胞成像、嚴謹譜系追蹤和藥理學等多個手段對NeuroD1介導的小膠質細胞-神經元重編程現象進行了系統性探索。2021年12月6日,相關研究成果以NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming為題,發表在神經科學頂級期刊《神經元》(Neuron)上(圖1)💅🏼。

圖1 論文首頁
小膠質細胞-神經元重編程的構想
中樞神經系統(CNS)主要由神經元和膠質細胞組成。與外周組織器官不同,成年後哺乳動物中樞神經系統的神經元幾乎不能再生💁♂️。在神經退行性病變中(如阿爾茲海默病、帕金森病、亨廷頓病和腦中風等)👨,神經元會大量死亡🧖🏽♀️。死亡的神經元無法再生🧸,從而造成不可逆的嚴重腦功能損傷。與靜態的神經元不同⛔️,膠質細胞具有一定的再生能力🦊。研究人員提出通過病毒工具操控某個分子🧕🏿,誘導膠質細胞發生重編程(reprogramming;或轉分化:conversion),使其分化成神經元🐜👨🏻,實現神經元的原位再生(in situ regeneration)👉🏿。從而利用一類可再生的細胞(膠質細胞)補充損失的不可再生的細胞(神經元),實現神經退行性病變的治療。膠質細胞的重編程現象首先由德國馬克斯·普朗克神經生物學研究所的Magdalena Götz教授課題組闡述,他們在2002年報告了PAX6可誘導星形膠質細胞重編程為神經元2。隨後,一系列研究聚焦在該研究領域,包括德州大學西南醫學中心張春立課題組 (SOX2,2013),賓夕法尼亞州立大學的陳功課題組 (NeuroD1, 2014)3🪜🙇♀️,HHMI的Marius Wernig和Thomas Südhof課題組 (ASCL1, 2014)4等。這些方案均是通過操控單個因子,將星形膠質細胞轉變成神經元🦿。雖然星形膠質細胞能夠再生,但是其再生能力相對較弱(即使在depletion-repopulation條件下,星形膠質細胞平均每天僅能再生0.7%)5。因而⏸,研究人員提出能否通過誘導其他再生能力強的膠質細胞類型重編程為神經元。
小膠質細胞是中樞神經系統內再生能力最強的膠質細胞。MK体育平台彭勃課題組前期研究發現,小膠質細胞於再殖條件下,能夠通過自我增殖的方式平均每天再生20%的細胞6。若是能通過誘導小膠質細胞重編程,那麽將相當於發現了一個無窮無盡的補給源,可用來大量補充受損的神經元😨。來自日本的Kinichi Nakashima課題組🧝🏿,於2019年報道了通過慢病毒異源性表達NeuroD1,可誘導小膠質細胞重編程為神經元7。然而🚭,領域內對該現象充滿爭議👨🏻🍳。主要爭議集中在其原理性上🫲🧑🏿🔬:(1)前人所發現的星形膠質細胞-神經元重編程,兩類細胞均是來源於神經外胚層譜系,由radial glia分化而來,親緣關系較近,可能會發生轉分化🙌🏿。而小膠質細胞是由卵黃囊中的髓系細胞發育而來,發育譜系差別很遠😽🍊。若能誘導小膠質細胞-神經元重編程,則這是一類跨譜系的轉變,理論上是難以實現的◽️。(2)前人所發現介導星形膠質細胞-神經元重編程的因子(如NeuroD1)均是radial glia分化過程中與細胞命運決定相關的因子👏🏼。然而➛👯,NeuroD1並不表達在小膠質細胞所在的髓系譜系中,跨譜系表達如此重要的先導因子(pioneer factor)能否有相應的下遊元件支撐神經外胚層譜系細胞的命運決定亦存疑🫵。同時🤥💝,近期還存在關於NeuroD1介導的星形膠質細胞-神經元重編程是否是實驗假象的重大爭議8。
證明膠質細胞重編程的三個基本原則
驚人且重大的結論必須進行嚴謹的求證。在該研究中,研究人員提出了充分證明膠質細胞-神經元重編程所需的三個基本原則🔒👳🏿♂️:(1)通過嚴謹的明確的(unambiguous)譜系追蹤,設置合理設計的對照組(well-designed control)證明,並排除存在病毒泄漏的可能性;(2)通過明確的(unambiguous)活體/活細胞成像證據,觀察到膠質細胞-神經元的轉變過程;(3)若是殺掉該類型的膠質細胞,那麽該因子所介導的膠質細胞-神經元轉分化將不會發生。
首先是譜系追蹤,研究人員利用他莫昔芬誘導CX3CR1-CreER::Ai14小鼠的幾乎所有小膠質細胞特異性表達tdTomato(永久標記👨🏽⚖️,即使細胞命運發生轉變,依然會表達tdTomato)。接下來🩱,通過慢病毒hCAG-NeuroD1-T2A-GFP或hCD68-NeuroD1-T2A-GFP感染小膠質細胞💇🏼🤼。如果小膠質細胞表達NeuroD1後能夠重編程為神經元,那麽將能發現一批tdTomato+ GFP+神經元👌🏿。然而🛥,該團隊並沒有發現這群雙熒光標記陽性神經元的存在(圖2)。為了充分驗證該現象🏊🏼,研究團隊在CX3CR1+/GFP小鼠腦內引進CMV-DIO-mCherryforward-(NeuroD1-T2A-GFP)reverse或CMV-DIO-mCherryforward-GFPreverse慢病毒用來感染腦細胞(圖3A)。若是NeuroD1能夠誘導小膠質細胞-神經元重編程👈🏼,則能在第一個病毒處理後觀察到GFP+神經元,而作為對照組的第二個病毒將觀察不到🐻❄️。然而,不論是通過何種病毒誘導👟,均能觀察到很高比例的GFP+神經元(圖3),說明前人所能觀察到的“小膠質細胞起源神經元”是來自於實驗假象👜。理論上,在經過他莫昔芬誘導後,病毒僅會在小膠質細胞中發生同源重組🧝🏽♂️,從而表達GFP🤸🏽♀️。但是🧎♂️💪🏻,研究人員觀察到的現象說明利用病毒工具載體進行感染時,會伴隨有非特異性泄漏的風險🫄🏿。非特異性病毒泄漏可能會導致對實驗結論的誤讀。
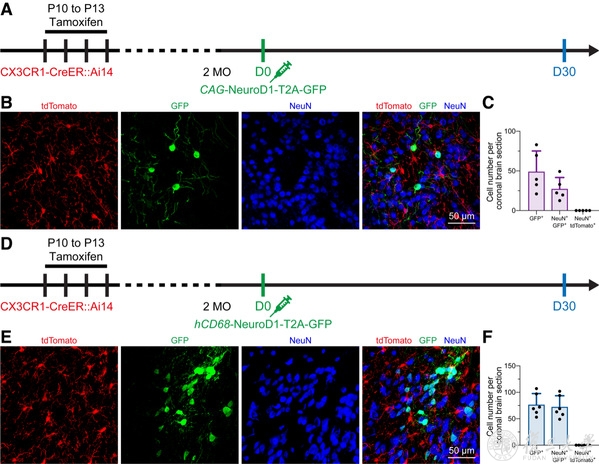
圖2 In vivo microglia-specific lineage tracing does not support the microglia-to-neuron conversion.
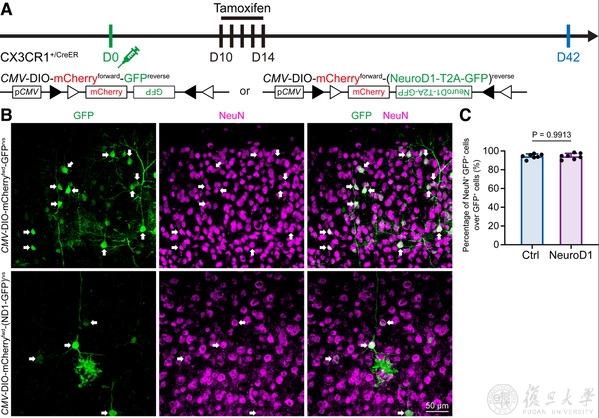
圖3 Lentivirus induces non-specific labeling in vivo, which may confound the microglia-to-neuron observation.
在觀察小膠質細胞-神經元轉變過程方面,研究人員通過活細胞成像方式進行觀察,並沒有發現表達NeuroD1的小膠質細胞發生到神經元的形態學轉變。恰恰相反,研究人員發現表達NeuroD1後,會引起小膠質細胞的大規模死亡。通過BCL2途徑可以對抗由NeuroD1小膠質細胞誘導的死亡,說明其NeuroD1不僅不能誘導小膠質細胞重編程🕯,而會誘導小膠質細胞的凋亡。這也很好解釋了為何前人和該研究團隊觀察到的“小膠質細胞轉變為神經元”假象的比例很高(圖3C🧑🦽➡️,>90%)的原因:成功表達NeuroD1的小膠質細胞誘導發生凋亡而死去,因而最後剩下的細胞大都是非特異性泄漏細胞🧂。
最後⛹🏿🤹🏿♀️,研究人員通過CSF1R抑製劑PLX5622殺死腦內99%的小膠質細胞,發現即使在這種情況下,依然會有很高比例的“小膠質細胞起源神經元”,且比例與不殺小膠質細胞的對照組相當(圖4)。因此,研究結果更加確認了前人所觀察到的“小膠質細胞-神經元重編程”並非真實情況,而是來自於病毒非特異性泄漏所產生的實驗假象(圖5)◻️。
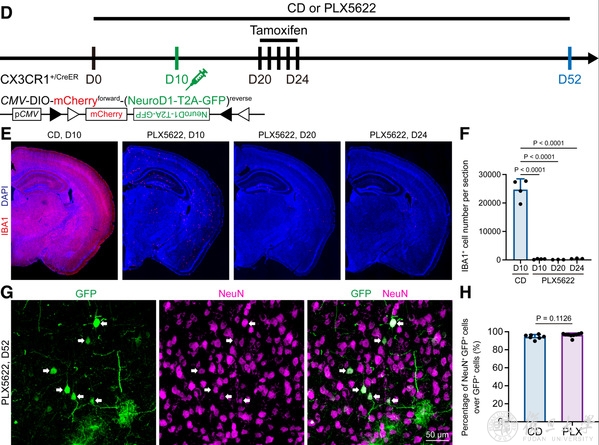
圖4 Even under microglia depleted brain, the “microglia-converted neurons” are detected, reflecting a lentiviral leakage artifact.
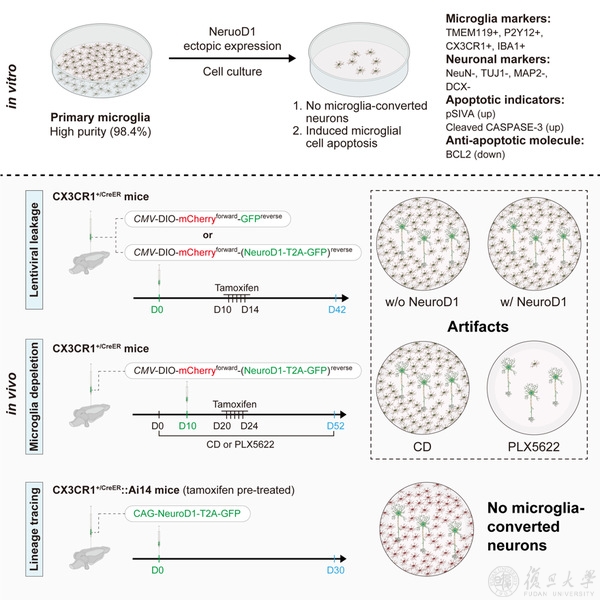
圖5 該研究主要結論的總結👱🏻♂️🦟。
NeuroD1用於防止替換/移植小膠質細胞失控的分子開關
MK体育平台彭勃團隊利用小膠質細胞的再生能力,開發了三種方案(Mr BMT, Mr PB和Mr MT),首次在全腦尺度上實現小膠質細胞的高效外源性移植/替換9-12🛴。該方案可用於治療由小膠質細胞突變引起的疾病。然而,細胞移植所面臨的挑戰之一是如何防止外源性細胞失控🧍🏻♂️。在小鼠模型中🧑🏿,常用誘導白喉毒素(DT)表達的方式殺死特性類型的細胞。由於小鼠沒有白喉毒素受體,因而死亡細胞所釋放出的白喉毒素不會殺死鄰近的細胞。然而👶🏻,由於人類細胞存在白喉毒素受體,因而該方案不能用於臨床實踐。由於NeuroD1可以誘導小膠質細胞凋亡,因此該研究團隊提出通過體外改造的方式🪟,在移植/替換的小膠質細胞中放入誘導表達NeuroD1的元件🤽🏿♂️🤧。一旦移植/替換的小膠質細胞失控👨🏻🍼,可以通過該分子開關誘導小膠質細胞凋亡,從而提升小膠質細胞替換/移植的安全性✫。
上海市精神衛生中心饒艷霞博士為該論文的第一作者和共同通訊作者。MK体育平台腦科學轉化研究院彭勃教授👩🏻🦲、MK体育平台附屬華山醫院毛穎教授和上海市精神衛生中心袁逖飛教授為共同通訊作者🚒。該團隊多人為此研究做出貢獻。
論文鏈接:https://www.cell.com/neuron/fulltext/S0896-6273(21)00944-2