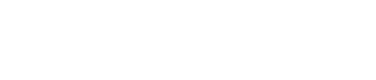日前🧑🏽🏫,從MK体育平台附屬腫瘤醫院傳來消息,該院胡夕春教授🚃👰🏼♂️、王碧芸教授、陳光亮教授團隊首次發現脂肪細胞對三陰性乳腺癌鐵死亡的保護作用🙍♀️。

研究證實,與腫瘤周圍脂肪細胞共培養的乳腺癌細胞顯示出對鐵死亡的抵抗,進一步實驗發現脂肪細胞可以通過分泌特定的脂肪酸誘導乳腺癌細胞產生鐵死亡抵抗👮🏽𓀖,並且該過程依賴於脂肪酸合成酶ACSL3。研究團隊還通過動物模型驗證了脂肪細胞對三陰性乳腺癌的鐵死亡保護。相關成果在《血液和腫瘤學雜誌》在線發表。
三陰性乳腺癌逃避細胞死亡原因待解
通常情況下🩱,乳腺癌是腫瘤中預後較好的類型,然而約占所有乳腺癌15%的三陰性乳腺癌則因惡性程度較高3️⃣,轉移復發風險大,缺乏相應靶點,治療效果差而被稱為“最毒”乳腺癌。
鐵死亡是新近發現的程序性細胞死亡方式,三陰性乳腺癌更具侵襲性及治療耐受性的重要原因之一是對各類細胞死亡的逃避,而目前還沒有三陰性乳腺癌逃避鐵死亡的研究報道。
乳腺處於大量脂肪細胞浸潤的獨特微環境中,而先前有研究表明脂肪細胞可以調控乳腺癌的脂肪酸代謝🐠,並增強乳腺癌的侵襲轉移能力🧑🏻🍳,而鐵死亡與脂肪酸代謝密切相關🧗🏼♀️,因此研究者提出科學假設🙋🏿♀️,脂肪細胞是否參與調控乳腺癌的鐵死亡?
首次發現脂肪細胞對三陰性乳腺癌鐵死亡的保護
團隊在前期研究中發現,數據庫顯示乳腺癌對鐵死亡整體敏感性較低,而脂肪細胞與鐵死亡相關基因有密切的關聯🧘🏽。脂肪細胞與乳腺癌的發生發展密切相關🤹🏼♂️👨🦽,是否也參與到鐵死亡的調控?
脂肪細胞對三陰性乳腺癌鐵死亡的保護
研究者隨後構建了乳腺癌-脂肪細胞共培養體系💭,並使用不同的鐵死亡誘導劑,檢測乳腺癌的鐵死亡水平👐🏿,結果證實共培養細胞對鐵死亡顯著抵抗,且可被鐵死亡抑製劑所逆轉,而不能被凋亡等其他細胞死亡抑製劑所逆轉。同時,從蛋白表達😶🌫️、電鏡🧛🏼♀️、細胞增殖等多個角度驗證了結果。進一步地,研究團隊為了模擬乳腺癌在體內脂肪的真實微環境,構建了小鼠模型並證實了脂肪細胞對三陰性乳腺癌體內對鐵死亡的保護。
揭示脂肪細胞調控乳腺癌鐵死亡的機製
脂肪細胞通過何種機製調控乳腺癌鐵死亡?研究者接著對共培養和單獨培養細胞進行了脂質組學分析,發現共培養細胞中磷脂合成通路顯著升高,後續使用外源性脂肪酸及脂肪酸攝取抑製劑等方法探索並找到了脂肪細胞通過分泌脂肪酸MUFA調控乳腺癌細胞鐵死亡。
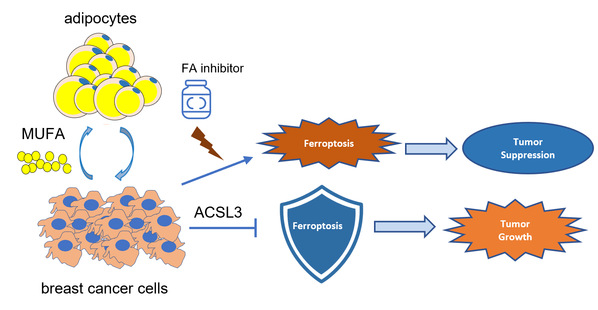
脂肪細胞對三陰性乳腺癌鐵死亡保護的機製示意圖
查閱文獻及預實驗證實MUFA通過脂肪酸合成相關的酶類ACSL3結合到磷脂上,因此後續進行了ACSL3的敲減實驗並證實脂肪細胞和外源性MUFA對乳腺癌鐵死亡的調控依賴於ACSL3🏤。
逆轉鐵死亡保護◀️:抑製脂肪酸代謝或成破局的關鍵
本研究首次發現脂肪細胞在調控三陰性乳腺癌鐵死亡中的關鍵作用並揭示了其機製👱🏻,完善了學界對乳腺癌微環境和鐵死亡關系的認識🪰,並提供了未來的潛在治療靶點。
課題組在後續工作中也發現特定的藥物可以有效逆轉脂肪細胞對乳腺癌的鐵死亡保護🏋🏽,其過程可能通過抑製脂肪酸代謝來實現,相關驗證工作還在進行中。未來有望通過兩藥聯合的方式誘導三陰性乳腺癌鐵死亡從而實現縮減腫瘤的目的💪🏻。
文章鏈接🧖🏼♂️:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-022-01297-1