2022年8月1日,MK体育平台放射醫學研究所邵春林教授團隊在Autophagy上在線發表題為“SDC1-dependent TGM2 determines radiosensitivity in glioblastoma by coordinating EPG5-mediated fusion of autophagosomes with lysosomes”(https://doi.org/10.1080/15548627.2022.2105562)的研究論文👊🕣,該研究揭示了膠質母細胞瘤中轉谷氨酰胺酶TGM2通過多配體聚糖SDC1依賴的方式轉運至溶酶體,促進束縛因子EPG5介導的自噬體-溶酶體融合,最終增強腫瘤的輻射抵抗,為膠質母細胞瘤放療提供新的潛在增敏靶點。
膠質母細胞瘤(GBM)是WHO IV級的惡性腦腫瘤⇒,是最致命的人類癌症之一,5年生存率僅為7.2%🏄🏻♀️。GBM多呈浸潤性成長👨🏿🎓,外科手術很難做到真正的完全切除🎽,而放射治療可有效殺滅或者抑製殘余的腫瘤細胞👩🦱,因此目前臨床上將術後聯合放化療作為神經膠質瘤的標準治療方案。然而,大量報道證實GBM對電離輻射並不敏感🏃🏻♂️,這也是限製患者生存率的最重要因素之一。因而,深入開展GBM放療耐受的調控基因及主要機製的研究🫸🏽,不僅可以從細胞及分子水平系統揭示輻射耐受的深層機理,更能通過靶向調控這些關鍵的基因或蛋白👰🏿♀️,提高臨床神經膠質瘤患者放療的療效🔀,有效改善患者預後👛。
SDC1 是一類跨膜硫酸乙酰肝素蛋白聚糖🚻🏊🏻♂️,TGM2 是一種通過谷氨酰賴氨酸等肽鍵催化蛋白質之間交聯的酶👩🦱。這兩種分子被報道與包括腫瘤在內的多種疾病發生發展相關♥️。不過,到目前為止🛟,還沒有關於SDC1 和TGM2 在輻射抵抗GBM患者中的臨床價值以及這兩種分子之間相互作用的報道。
邵春林教授團隊通過大數據分析🤼🦸🏻,結合細胞蛋白組學和臨床病理切片分析,發現SDC1與TGM2是兩個協同促進膠質母細胞瘤輻射抵抗的生物標記物,抑製SDC1與TGM2蛋白表達水平顯著的增強了GBM細胞的輻射敏感性😌。進一步研究發現☢️,細胞自噬水平在GBM的輻射抵抗發生發展中發揮了重要作用,而SDC1與TGM2可以通過調控自噬進程中關鍵“清道夫”——自噬溶酶體的形成🕵🏼♂️,介導細胞的輻射抵抗🏌🏽♂️。分子機製研究表明,膠質瘤受輻射後,細胞表面的SDC1發生內化🔖𓀂,攜帶TGM2轉運至溶酶體👨🏻🎤,TGM2利用其自身兩個LC3相互作用區與自噬體LC3結合,促進定位於溶酶體的束縛因子EPG5與LC3結合,進而捕獲自噬體並招募裝配QabcR SNARE復合體(VAMP8-STX17-SNAP29)。該自噬溶酶體的形成🤰🏽,增加了膠質瘤的輻射抵抗性(下圖)。臨床轉化研究方面🏌🏻🙍🏿,該團隊發現給予口服TGM2抑製劑——胱胺二鹽酸鹽可顯著提高原位移植腫瘤的放療緩解效果,有效延長小鼠生存期。
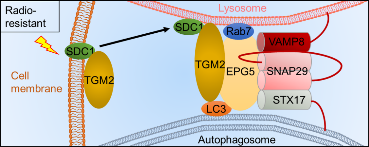
圖✋🏻:TGM2協同SDC1促進EPG5的束縛因子功能增強膠質母細胞瘤輻射抵抗
MK体育平台放射醫學研究所邵春林教授為該論文的首要通訊作者,副研究員張江虹和潘燕為共同通訊作者,博士研究生鄭旺和陳倩萍為論文的共同第一作者🧓🏼。