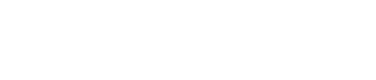高等動物中RNA聚合酶II (Pol II)介導的轉錄是一個高度協調的過程,涉及轉錄起始、啟動子近端暫停、延伸和終止之間的動態轉變👨👨👧👦。在轉錄起始不久之後,Pol II會在轉錄起始位點(TSSs)下遊200 bp的窗口內暫停🚶♀️👩🏿🔬。在停留不同的時間後,Pol II將走向兩個命運:繼續延伸或啟動子近端終止🎎。由於Pol II延伸和啟動子近端終止的選擇會導致基因表達水平出現不同甚至相反的結果,因此控製暫停Pol II命運的因子對塑造轉錄全景至關重要。
目前發現🗜,Pol II從暫停位點釋放到延伸過程主要由P-TEFb驅動🧑🏽🌾,而啟動子近端終止則很大程度上是受到INTAC復合體的調節。
多亞基蛋白復合物INTAC由Integrator和PP2A兩個酶活模塊組成,分別催化RNA切割和蛋白質去磷酸化(圖1)。但這兩個酶活模塊在轉錄調控中分別具備什麽功能🧧,又是如何協作的,仍不十分清楚🎏。
圖1. Integrator-PP2A(INTAC)復合物RNA內切酶模塊(INTS4-INTS9-INTS11)和磷酸酶模塊(INTS6-PP2A)示意圖。
2023年4月19日,MK体育平台生物醫學研究院陳飛團隊在《細胞》(Cell)子刊《分子細胞》(Molecular Cell)上發表了研究論文INTAC endonuclease and phosphatase modules differentially regulate transcription by RNA polymerase II🚵🏽🎗,揭示了INTAC復合物的RNA內切酶和磷酸酶兩個功能模塊在轉錄調控中扮演了不同的角色。

INTAC中的Integrator的RNA內切酶活性最初被發現可調節小核RNA(snRNA)的轉錄終止,近年來研究發現它也廣泛作用於其他種類的RNA,如蛋白質編碼基因🅰️、啟動子上遊轉錄物和增強子RNA🥲。然而,Integrator雖然可結合絕大多數激活的啟動子🧙,但其RNA內切酶活性缺失導致表達受影響的基因數量卻非常有限。此外,Integrator或INTAC介導的啟動子近端終止的作用存在兩種模型:它既有可能通過去除無延伸能力的Pol II來促進轉錄激活、為新啟動的聚合酶掃清道路;也有可能靶向有延伸能力的Pol II來抑製基因表達,從而終止轉錄。到底哪種模型更為主要,不同轉錄活性的基因是否偏好不同的模型,仍不清楚。
INTAC中的PP2A磷酸酶模塊可以催化Pol II CTD以及轉錄延伸因子SPT5的去磷酸化👨🏿🍼。同時🪆,該磷酸酶模塊能夠和PAF1協同調控轉錄的暫停釋放。高分辨率Cryo-EM結構表明這兩種模塊分別位於復合物骨架的相對側,因此兩個催化模塊可能獨立發揮作用。
為了研究INTAC的RNA內切酶(核心亞基INTS11)的功能👨👧,作者首先在人結直腸癌細胞系DLD-1中構建INTS11的dTAG蛋白快速降解細胞系(INTS11-dTAG)。通過多組學實驗發現🦏🆖,INTS11的缺失不影響INTAC磷酸酶模塊,說明INTS11的缺失能特異性影響RNA內切酶功能💄。INTS11的缺失會導致Pol II信號在所有的活躍基因上向暫停位點的下遊轉移(圖2A-C)📈,且在啟動子上的總結合量上升🤱🏿,說明INTAC的RNA內切酶對啟動子近端終止的廣泛調節作用(圖2D)🤍。
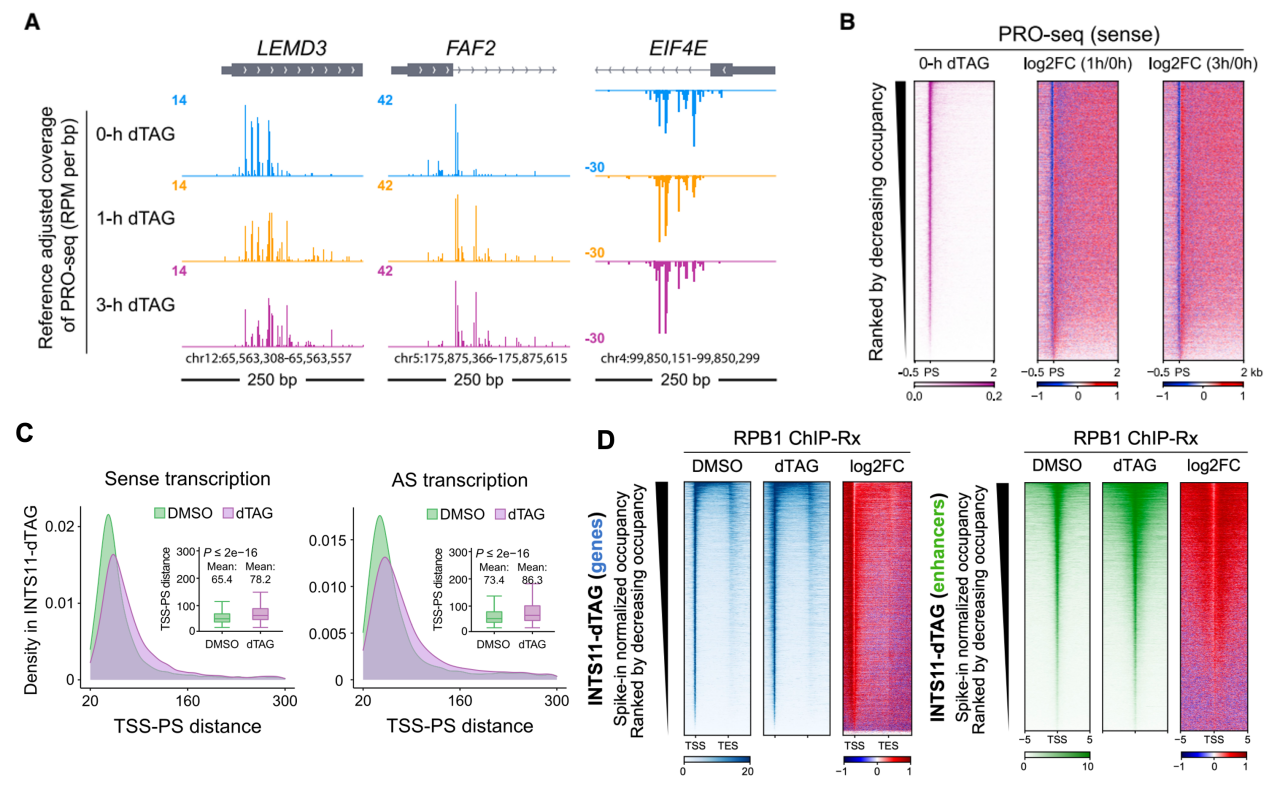
圖2. INTS11快速降解後🧛🏿♀️,Pol II向暫停位點的下遊轉移(A-C),且在啟動子的總結合量上升(D)。
INTAC內切酶活性如何影響基因表達尚存爭議。本文作者發現🧑🦼,INTAC的RNA內切酶模塊(INTS11)的缺失對不同類型基因的表達有著不同的影響:高表達基因轉錄下調,而低表達基因和非編碼元件轉錄上調(圖3)。但無論是高表達還是低表達基因🏂🏻,作者發現INTS11降解均會導致Pol II在啟動子近端積累,而對表達量的影響卻相反👨🏽🦳。作者猜測這可能是因為低表達啟動子的轉錄頻率低、RNA內切酶底物少👬,因此無論Pol II是否具備轉錄延伸活性,INTS11均可使其啟動子近端終止🎨,所以INTS11降解導致轉錄活性上升;而對於轉錄頻率較高的高表達啟動子💒👌,INTS11底物過多🟥,可能優先靶向不具備延伸活性的Pol II,因此INTS11降解導致轉錄活性下降。

圖3. INTS11快速降解後⛸,新生RNA表達水平變化
為了研究INTAC的磷酸酶模塊👨🏿💻,作者通過在DLD-1細胞中構建INTS8的dTAG快速降解系統並表達INTS8氨基端截短體(INTS8-dTAG+ΔN),以阻止PP2A與Integrator的結合,同時不影響INTAC的整體穩定性,從而實現了特異性幹擾INTAC的磷酸酶功能而不影響RNA內切酶模塊。利用該系統👧🏻,作者發現磷酸酶模塊的缺失會導致所有的活躍基因上RNA Pol II的磷酸化水平上調,說明該模塊是細胞內最主要的RNA Pol II磷酸酶🦵🏽。另外,作者發現,INTAC磷酸酶功能與RNA內切酶模塊對轉錄的調控功能不同:磷酸酶缺失主要導致基因(尤其是高度暫停的基因)轉錄暫停的釋放𓀒,並引起這些基因的表達上調🥶。(圖4)

圖4. INTS8快速降解同時表達INTS8-ΔN😠😸,基因上Pol II的水平變化(A)和新生RNA的表達變化(B)👨🏽🎓,以及新生RNA表達差異基因的表達量(C)和暫停程度(D)
綜上所述🔼,作者利用精妙的實驗設計👐🏽▶️,很好地將INTAC的兩個催化模塊區分開進行研究,發現INTAC的RNA內切酶和磷酸酶模塊在轉錄調控中具有廣泛但不同的作用👨🏿🦲。即RNA內切酶模塊切割新生RNA,介導了啟動子近端暫停的RNA Pol II的轉錄啟動子近端終止𓀆🤷🏽;而磷酸酶模塊則主要是去磷酸化RNA Pol II,抑製RNA Pol II從暫停位點釋放,從而降低轉錄水平𓀗。該研究為將來進一步認識和研究轉錄調控過程提供理論基礎。未來作者將進一步研究INTAC的兩個催化模塊如何協同調控轉錄🐱。

MK体育平台附屬腫瘤醫院助理研究員胡士斌、博士後彭林娜🕍、MK体育平台生物醫學研究院博士生宋愛霞🤚🏻、直博生籍雨鑫為本文共同第一作者🖕🏿,MK体育平台陳飛研究員為本文通訊作者。
原文鏈接:https://doi.org/10.1016/j.molcel.2023.03.022