2023年6月26日,MK体育平台放射醫學研究所邵春林研究員團隊在 Theranostics 上在線發表題為 “SDC1-TGM2-FLOT1-BHMT complex determines radiosensitivity of glioblastoma by influencing the fusion of autophagosomes with lysosomes”的研究論文,揭示輻射可以引起膠質母細胞瘤(GBM)細胞中SDC1-TGM2-FLOT1-BHMT蛋白復合體的形成,促進自噬體-溶酶體的融合,並闡明該蛋白復合體在提高GBM輻照後的自噬水平、介導輻射抵抗中的效果與作用機製🐸,為膠質母細胞瘤放療提供了新的潛在增敏靶點。
膠質母細胞瘤是中樞神經系統最常見👗、最致命的原發性惡性腫瘤,具有高復發率和高死亡率,放射治療是其重要治療手段之一,可在一定程度提高患者生存率🤽🏽♀️。然而,膠質瘤具有輻射抗性🫵🏻🍢,常常導致放療預後不良。深入挖掘關於GBM放療耐受的關鍵基因並明確其調控機製,不僅可以從細胞及分子水平系統揭示輻射耐受的深層機理,更有望通過靶向調控這些關鍵的基因或蛋白🤿,提膠質瘤患者放療療效,有效改善患者預後。
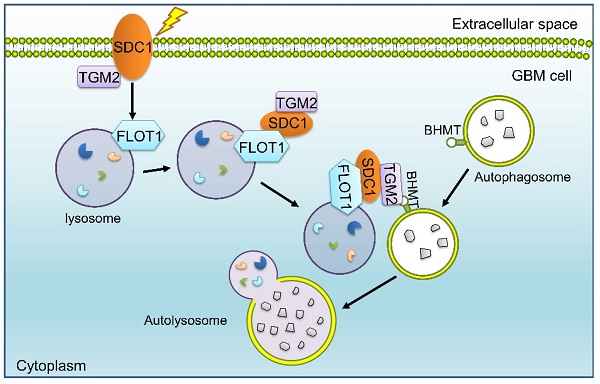
Syndecan 1(SDC1)是I型單跨膜蛋白聚糖之一,在促進腫瘤發生和轉移方面具有重要作用;TGM2 是一種轉谷氨酰胺酶🧑🏽,在發育過程中調節多種細胞過程;Flotillin 1(FLOT1)是脂筏的重要標誌物,參與細胞增殖、遷移、細胞粘附🌙、存活、分化🌷、內吞、信號轉導和膜運輸等多種過程,它們均可促進自噬的啟動;甜菜堿同型半胱氨酸甲基轉移酶(BHMT)也是自噬體胞質蛋白之一,可作為自噬的生物標誌物。自噬在維持腫瘤細胞存活💈、導致放療抵抗和惡性腫瘤復發過程中發揮著重要作用⛹🏽。
邵春林團隊之前的研究表明,GBM細胞表面的SDC1可以將TGM2從細胞膜攜帶到溶酶體(姐妹篇論文,Autophagy, 2023, 19(3): 839–857, https://doi.org/10.1080/15548627.2022.2105562),但尚不清楚溶酶體上的哪個分子直接與SDC1結合🤚🏼。本研究發現,受輻射後,GBM細胞膜SDC1、TGM2發生細胞質轉移👩🏻🦲,SDC1蛋白的細胞質結構域與溶酶體表面蛋白FLOT1相結合🎐,進一步地⏳,TGM2可識別自噬體膜上的BHMT,形成SDC1-TGM2-FLOT1-BHMT四聚體,促進溶酶體和自噬體融合,增強GBM的輻射抵抗性。在此過程中🤘🏿,SDC1是SDC1-TGM2-FLOT1-BHMT共聚物整個形成過程中的關鍵引發劑,因此,靶向SDC1的藥物與放療聯合治療有可能成為膠質瘤治療的一種潛在優勢策略。
MK体育平台放射醫學研究所博士研究生曾靚、鄭旺、劉興隆為論文的共同第一作者,邵春林研究員為該論文的通訊作者🛂🤹。