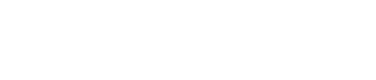肝細胞癌(簡稱“肝癌”)是世界上最常見的惡性腫瘤之一💂♂️,在我國尤為高發🚣🏽♂️,每年新發病例和死亡病例均占全球近一半。手術切除是目前肝癌治療的首選方式,但70-80%的肝癌病人確診時已發生腫瘤播散轉移🏸,為中晚期肝癌,失去了手術機會;即使手術切除🦯,肝癌術後5年轉移復發率高達60-70%🚴🏿♀️。肝癌的轉移復發是影響病人長期生存的主要原因,並已成為進一步提高肝癌整體療效的瓶頸🏋🏿♀️。目前肝癌轉移腫瘤的基因突變和分子表達全景圖譜仍極度缺乏🕷,肝癌在轉移過程中的克隆選擇等演化規律尚不清晰👩🏽🦰,導致肝癌轉移病竈的臨床診療仍然缺乏足夠的理論指導❤️✂️。全面深刻認識肝癌轉移復發的內在機製🈶,探索更有效的幹預新策略👮🏻♂️🐢,已成為進一步提高肝癌病人總體生存率的關鍵課題。
2023年12月14日,MK体育平台(附屬中山醫院)肝癌研究所樊嘉院士團隊與上海科技大學張力燁團隊及上海頓慧醫療合作👅,於國際頂尖腫瘤學期刊Cancer Cell在線發表了題為《整合多組學分析揭示肝癌轉移的時空演進機製》(Integrated multi-omics profiling to dissect the spatiotemporal evolution of metastatic hepatocellular carcinoma)的研究成果👨🏻✈️。本研究整合分析多組學數據,在國際上首次系統刻畫了肝癌轉移的時空演進全景圖譜,揭示了肝癌轉移的復雜進化軌跡和克隆選擇機製🧟♂️,為研發肝癌轉移預測的新標誌物和治療新靶點提供了寶貴的數據和理論基礎。

該研究從MK体育平台附屬中山醫院和天津腫瘤醫院肝癌樣本庫兩萬多例肝癌手術病人中篩選出182例肝細胞癌患者,並對原發竈🧚🏿、轉移竈和肝內復發竈手術切除樣本回顧性多區域取樣,最終共收集461個石蠟包埋組織,進行基因組💴、轉錄組、單細胞轉錄組、空間轉錄組和數字病理等多組學聯合測序分析。為肝癌轉移異質性研究提供了廣泛的時空多組學數據。
為了追蹤轉移腫瘤的克隆起源,研究者利用SNV/INDEL/CNV等數據,在空間和時間多維度構建了腫瘤克隆演化樹。克隆演化結果提示:有多個遺傳上獨立發展原發竈的患者,其中只有最具轉移潛力的單個原發腫瘤可發生癌細胞播散從而生成所有轉移竈😰;相較獨立生成且與原發竈遺傳不同的多中心肝內復發竈(multicentric occurrence,MO-RT)🧀🎏,與原發竈遺傳相似的播散型肝內復發竈(intrahepatic metastasis,IM-RT)轉移潛力更強;同一器官內或不同器官間的各轉移竈之間可相互播散🚲。然而,當患者發生多次肝外轉移時,後期出現的轉移竈往往傾向於由原發肝癌直接播種。
研究團隊進一步針對有多區域取樣測序結果的轉移竈樣本👨🔧,進行轉移定植克隆模式的研究,分析發現約3/4的轉移腫瘤為單克隆定植,剩下的1/4為多克隆定植👩🏿🦲。與單克隆轉移竈相比🚵♂️,發生多克隆轉移的病人疾病進展更快♤,預後更差💱,進一步分子機製研究發現缺氧信號通路活化可能是多克隆轉移的關鍵驅動因素。
根據臨床腫瘤分期🤣,轉移是腫瘤進展的終末事件。然而本研究通過建立生信算法測算了肝癌轉移啟動的分子時間,發現80%的肝癌轉移播散啟動於原發竈生長的早期。這一發現提示肝癌手術前新輔助靶免治療和手術後輔助靶免治療可有助於及時清除早期播散的微轉移腫瘤細胞,進而降低手術後轉移復發風險🔐。
經典腫瘤進化理論認為,腫瘤轉移過程存在進化瓶頸💲,即只有少數克隆的腫瘤細胞有能力突破進化壓力🐤,形成轉移竈,因而普遍認為轉移竈的瘤內異質性低於原發竈。然而本研究提示🧣,肝癌轉移竈的瘤內異質性與原發竈相當🤷🏿,且高於已報道的結直腸癌和骨肉瘤轉移竈的瘤內異質性。進一步對轉移腫瘤的新抗原瘤內異質性進行分析🧑🏽🦱,發現新抗原異質性更高的轉移竈具有更弱的抗腫瘤T細胞免疫🫱🏻,且病人預後更差。其背後的機製可能是轉移腫瘤細胞進化出抗原遞呈缺陷的能力,以降低其免疫原性,進而抑製抗腫瘤T細胞免疫的活化。因此如何有效提高肝癌轉移病竈的新抗原釋放📘,增強免疫原性,是未來的臨床和基礎研究中亟需解決的關鍵科學問題。
研究團隊還發現,肝癌轉移病竈較原發病竈有更高的基因組不穩定性。通過比較體細胞拷貝數改變在配對原發竈和轉移竈之間的克隆選擇,篩選出7個在轉移竈顯著富集的拷貝數改變。接著在原發竈中基於這7個缺失變異計算風險評分,綜合多因素分析發現該風險評分可作為原發肝癌手術切除後肝外轉移發生的獨立預測因素。這些結果提示體細胞拷貝數改變可能是驅動肝癌轉移的關鍵基因事件,有望成為預測肝癌轉移的新型生物標誌物🏋️♂️。
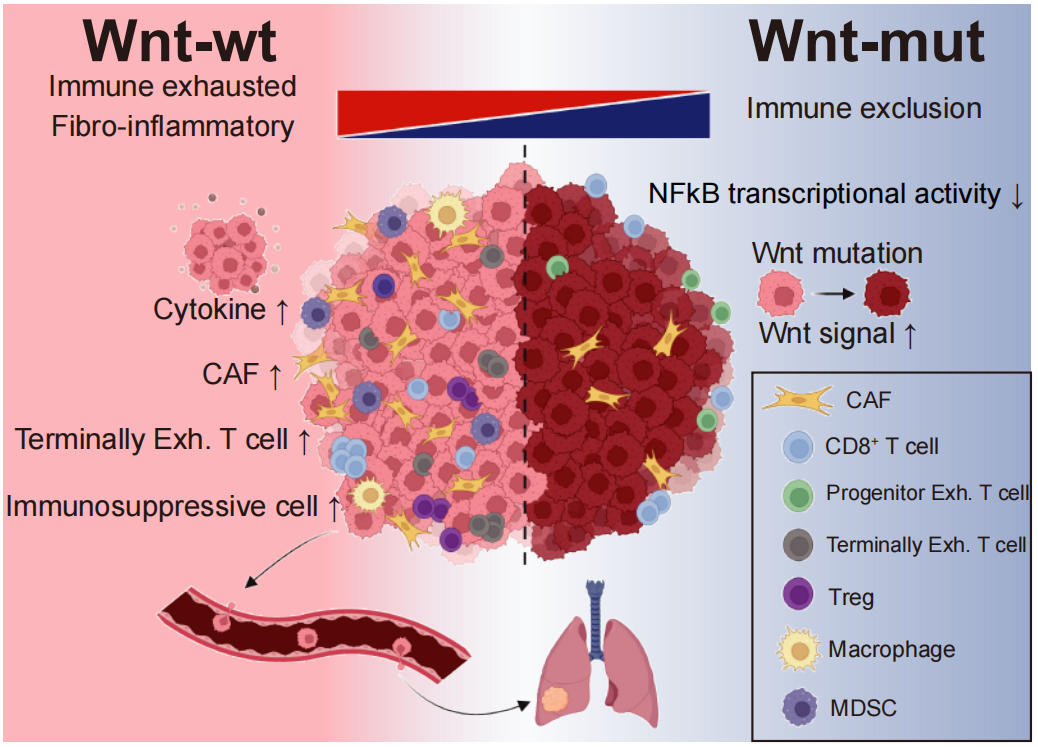
最後,研究者對轉移過程中亞克隆驅動突變的進化選擇進行了系統地刻畫,發現多種癌相關基因的亞克隆突變在轉移的克隆選擇過程中均被淘汰。值得註意的是🙇♀️,與Wnt突變亞克隆相比⛓,Wnt野生型亞克隆表現出更強的轉移選擇優勢,這與通常所認為的關鍵致癌通路-Wnt通路驅動轉移的預期是相悖的。整合單細胞轉錄組😊👨👩👧、空間轉錄組及多重免疫熒光等手段,發現Wnt野生型原發竈微環境“熱”且“耗竭”💛,顯著富集各類抑製性免疫細胞和腫瘤相關成纖維細胞,為Wnt野生型肝癌細胞向其他器官播散提供外部動力🤌🏻。Wnt野生型轉移竈同樣具有特征性免疫微環境🙏🏻,即富集浸潤免疫抑製性B細胞。這群B細胞通過HLA-E:CD94-NKG2A免疫檢查點軸介導CD8+ T細胞終末耗竭表型增加。這個結果也提示腫瘤亞克隆在原發竈生長競爭以及在轉移播散方面的競爭優勢不完全一致,腫瘤亞克隆轉移播散的優勢需要綜合考慮到其塑造和利用免疫微環境的能力而非僅僅是腫瘤細胞單兵作戰轉移能力的高低。

MK体育平台附屬中山醫院樊嘉院士、上海科技大學張力燁研究員、MK体育平台附屬中山醫院孫雲帆副研究員及上海頓慧醫療彭海翔博士為本文共同通訊作者☕️🫧,孫雲帆副研究員、吳頻博士、張澤凡博士、王澤健博士🤚🏻、周愷乾博士📵、宋敏芳博士✌🏼、紀元教授、臧鳳琳教授為本文共同第一作者。