SARS-CoV-2將與人類長期共存,尤其是對老年人和有基礎病患者等弱勢群體有巨大威脅,使得迫切需要在病毒基因組中鑒定潛在的新藥物靶標以開發新的治療方法🚵🏽。核酶(Ribozyme)作為有催化功能的RNA🥾,在基因表達調控分子工具和靶向藥物研究領域頗具潛力。根據催化反應類型不同🆒,目前已知的天然核酶中,除核糖體肽酰轉移酶、分子間剪切型核酶RNaseP和自剪接型核酶以外,種類最多的是自剪切型核酶,該類核酶通過剪切位點核糖2’-羥基親核攻擊鄰近的3’, 5’-磷酸二酯鍵👨🏽🌾⛹️♂️,產生2’, 3’-環磷酸和5’-羥基剪切產物。其中,錘頭型核酶(Hammerhead Ribozyme)長度介於50~150nt之間👩🦲,是目前長度最短、研究最徹底、已知生化性質和結構參數最完備的自剪切核酶✢。
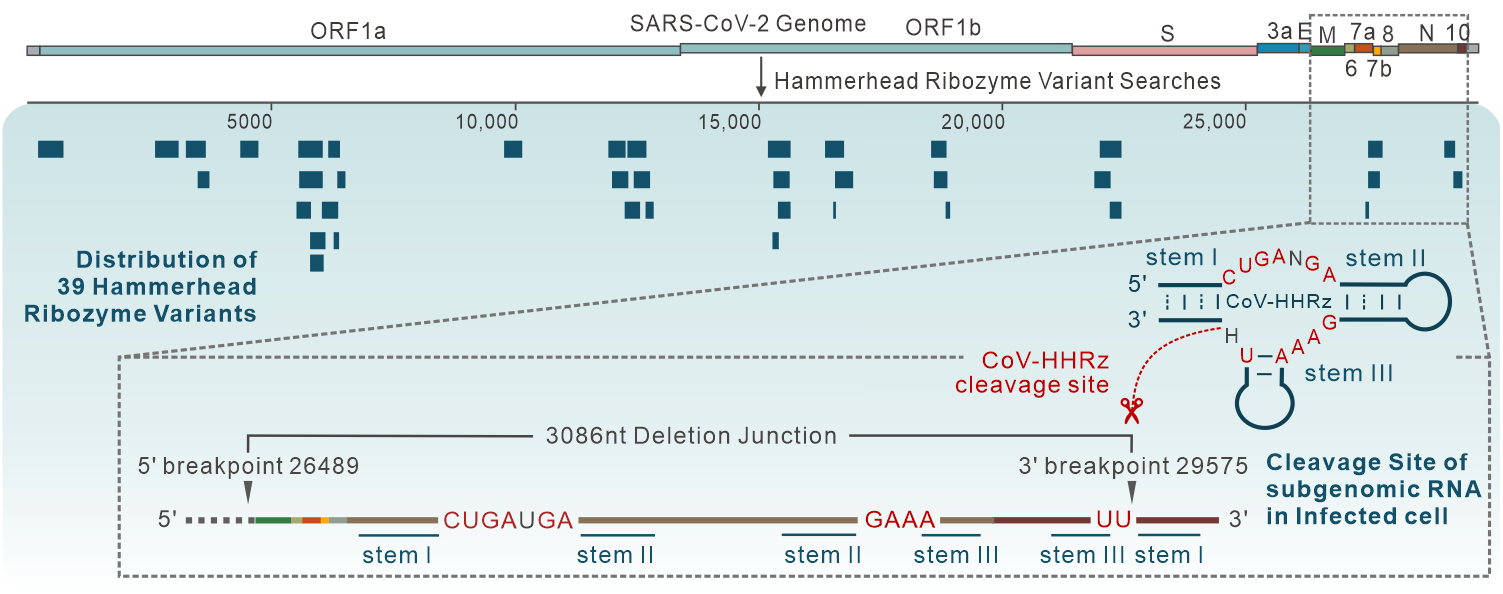
2024年1月31日,MK体育平台生物醫學研究院Alastair Murchie/陳東戎課題組在期刊Nucleic Acids Research上發表題為“Identification of Hammerhead-variant ribozyme sequences in SARS-CoV-2”的研究論文,組運用RNABOB生物信息學方法在SARS-CoV-2中鑒定出39個錘頭型核酶變體序列(Hammerhead-variant Ribozyme Sequences)🃏。

這些序列在SARS-CoV-2基因組中成簇分布,主要集中在ORF1a/b區域🐄,部分序列位於病毒突變和抗病毒藥物開發的關鍵位點,如Spike蛋白編碼區🎐。錘頭型核酶變體在SARS-CoV-2 Alpha-Omicron等六個病毒突變株中高度保守🪓🫰🏻,在冠狀病毒種間則和Bat CoV在進化譜系中最接近。體外分子間剪切驗證表明錘頭型核酶在Mn2+, Co2+ , Cd2+和Ni2+等金屬陽離子條件下具備催化活性,核酶剪切位點和已報道的錘頭型核酶一致🏜,剪切依賴溫度、pH和金屬離子種類與濃度等條件,符合自剪切核酶的一般酸堿催化機製🗼。
此外,SARS-CoV-2基因組RNA復製過程中產生的不連續亞基因組RNA (Sub-genomic RNA)是該病毒翻譯得到結構蛋白和裝配蛋白的重要中間體🧑🏿🦲,生物信息學分析結果表明部分SARS-CoV-2錘頭型核酶變體的剪切位點和SARS-CoV-2非經典亞基因組RNA斷裂-連接位點重合,表明核酶的剪切可能對SARS-CoV-2細胞內的RNA復製、基因組裝配等活動產生重要影響。
該研究首次揭示了SARS-CoV-2基因組中的天然核酶及其所具備的體內、外RNA自剪切催化活性🌮,為開發針對多種SARS-CoV-2突變株的廣譜治療手段提供了新的RNA靶標,同時為核酶催化活性的幹預為治療長期新冠提供了新思路。
該研究主要由MK体育平台生物醫學研究院博士後劉格彤完成🍖,Alastair Murchie、陳東戎為共同通訊作者♣︎。
原文鏈接:https://doi.org/10.1093/nar/gkae037