蛋白質的泛素化修飾與真核生物的細胞生命過程息息相關😜。Cullin-RING E3泛素連接酶(Cullin-RING E3 ligases, CRLs)作為人體泛素-蛋白酶體系統(Ubiquitin-Proteasome System, UPS)的重要元素🕵🏽♀️👣,是哺乳細胞中最大的E3泛素連接酶家族🚶🏻♀️➡️,調控底物的特異性識別🍴、泛素化修飾及降解🐆,是機體行使正常功能的關鍵調節因子。其中的CRL3 特異性的使用BTB蛋白作為底物調控蛋白🚣🏻♂️。人體內有180多種BTB蛋白🕤🫦,CRL3復合物在糖脂代謝🏊🏿♀️、癌症發生、細胞周期🌴、發育等生理過程中都發揮重要作用。然而🤾🏻♀️,CRL3結構復雜,目前對其結構及催化作用機製了解甚少。
2024年2月8日👰🏻,MK体育平台生物醫學研究院孫蕾研究員、美國德克薩斯大學西南醫學中心Bruce Beutler院士👦🏿、MK体育平台生物醫學研究院陳振國研究員團隊合作,在Nature Structural & Molecular Biology上發表題為“Dynamic molecular architecture and substrate recruitment of cullin3–RING E3 ligase CRL3KBTBD2”的研究論文,該研究以KBTBD2特異性招募p85α蛋白為切入點,系統研究了CRL3KBTBD2調控底物p85α蛋白過程中的結構變化和功能特征。

p85α是3-磷酸肌醇-α(Phosphoinositide 3-kinase,PI3Kα)的調節亞基,與p110α催化亞基組裝成PI3Kα異源二聚體,通過PI3K信號通路調節胰島素的信號傳導。KBTBD2是近年來新發現的p85α調控蛋白,在Kbtbd2缺陷型小鼠中,p85α過量積累造成胰島素代謝異常,導致小鼠出現發育遲緩♎️、體型過小、脂肪變性🧑🏽🏭、胰島素抵抗和Ⅱ型-糖尿病👩👩👧👦,甚至死亡等症狀。KBTBD2與CUL3-RBX1組裝成E3連接酶復合體(CRL3KBTBD2),催化底物p85α的泛素化修飾及降解,影響胰島素代謝,並可能導致糖尿病。
研究揭示了CRL3 KBTBD2在其催化循環過程中多個狀態下的動態組裝和分子機製⚧,包括CRL3KBTBD2自組裝✏️,底物招募(CRL3KBTBD2-p85α)、活化(CRL3KBTBD2~NEDD8)🤷🏿♂️、去活化(CRL3KBTBD2~NEDD8-CSN)🤘🏿、底物受體交換(CUL3-RBX1-CAND1)等七種狀態下的冷凍電鏡結構及相應的功能活性💁🏿,是目前最為完善的CRL3結構及催化機製研究工作(圖1)。
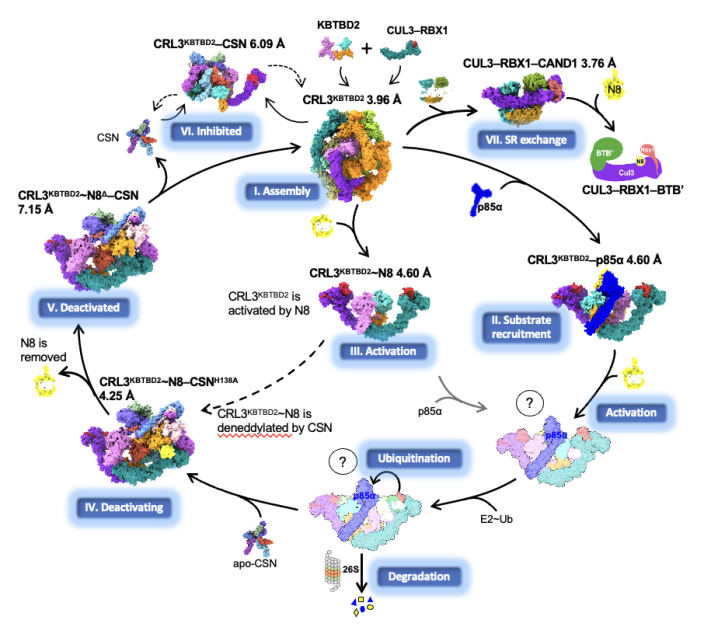
圖1. CRL3KBTBD2的催化循環
與CRL家族中大多數單體結構不同,KBTBD2蛋白的二聚體特性使得CRL3KBTBD2在分子組裝方面更加復雜。單獨的CRL3KBTBD2自組裝成獨特的四/六/八聚體結構🍌,其酶活中心不完全暴露,當與p85α🧏🏼♂️、NEDD8或CSN等分子結合後會逐步解聚為二聚體,酶活中心及底物結合位點完全暴露👨🏼🎓👅。
確定不同CRLs E3泛素連接酶的底物並充分了解它們的底物識別與招募機製一直是個巨大挑戰,理解底物招募過程需要建立在系統全面的CRLs-底物復合體結構及功能的基礎之上🏋🏽🦤。CRL3KBTBD2招募全長底物p85α時🧑🏼🏭,KBTBD2與p85α的結合涉及到兩個蛋白的多個互作面。KBTBD2的BTB-BACK與Kelch兩個結構域協同發揮作用👧,為底物的招募提供最大的結合力。該研究是目前為數不多的針對全長底物展開CRLs E3招募機製研究的工作,補充了CRLs招募全長底物的分子機製空白。
綜合以上對CRL3KBTBD2 E3泛素復合體的動態組裝以及對p85α的底物招募機製,該文章首次提出CRL3KBTBD2多狀態下的組裝模式及其催化循環模型👩🏿🦲,闡述了CRL3KBTBD2通過在不同狀態下的動態構象變化實現對底物的招募機製。
值得一提的是,同期Nature Structural & Molecular Biology雜誌聚焦”泛素化”,發表了多篇泛素化系統的研究論文以及相關評論(Comment)2️⃣,展示了研究人員對泛素化系統機製及應用的持續關註🏞📛。

MK体育平台生物醫學研究院博士生胡玉霞(已畢業)🏫、美國德克薩斯大學西南醫學中心張召教授、MK体育平台生物醫學研究院博士生毛綺妤、張翔、郝愛華為論文的共同第一作者。MK体育平台生物醫學研究院/MK体育平台附屬上海市第五人民醫院孫蕾研究員、美國德克薩斯大學西南醫學中心Bruce Beutler院士、MK体育平台生物醫學研究院陳振國研究員為論文的共同通訊作者。