細胞中的蛋白質翻譯是一項基本的生物學過程🤽🏽♂️,它將RNA中的遺傳信息轉化為功能性蛋白質,從而實現細胞的正常功能和活動🌐📦。在這一過程中🍇,翻譯的起始階段被認為是至關重要的,因為它涉及大量能量和時間💺。在真核細胞中,這一過程始於43S前起始復合物(PIC)的組裝,其中包括40S核糖體、eIF1🦿🧑🧑🧒、eIF1A🧑🏿🌾、eIF3復合物💃🏼、eIF5以及eIF2三聚體復合物(TC)。在正常的生長條件下🪘,這一過程能夠順利進行,確保了蛋白質的正常合成和細胞的正常功能🚾。然而,在面對外界壓力或應激條件時🖐🏿🙎🏽♂️,細胞會采取各種機製來抑製翻譯的起始過程💁🏻♂️,以適應不同的環境條件。盡管我們已經了解到了一些抑製翻譯的機製,但還有許多詳細分子機理仍然不清楚。
2024年4月19日,MK体育平台生物醫學研究院程凈東課題組在Cell Research在線發表了題為“Human tumor suppressor PDCD4 directly interacts with ribosomes to repress translation”的研究論文。在這項最新的研究中🫅🏻𓀄,他們聚焦於一類重要的腫瘤抑製因子——PDCD4,並詳細闡明了其在翻譯調控過程中發揮的新作用機製。

該研究發現👨🏻🦰😁,在正常細胞中🩲,PDCD4主要位於細胞核⇢👰🏻,但在面對壓力刺激時會遷移到細胞質中🐆。通過蔗糖密度梯度離心,他們觀察到在饑餓條件下👰🏻♀️,轉移到細胞質中的PDCD4主要與40S核糖體結合。為了探究PDCD4抑製翻譯的機製,他們使用了四環素誘導的PDCD4-Flag蛋白作為誘餌🤵🏽♀️,並從HEK293細胞中純化了內源PDCD4與核糖體復合物🧖🏿♂️。通過單顆粒冷凍電鏡分析,解析了PDCD4與核糖體的三種不同結構,分別命名為PDCD4-40S、PDCD4-eIF3G-40S和PDCD4-43S😗💄。在這三種復合物結構中,研究人員發現PDCD4的N端片段(第100-145個氨基酸)位於mRNA進入通道內🥖,因此將其稱為核糖體結合區(RBR)。進一步的結構分析表明,PDCD4的RBR區域通過占據mRNA進入通道,通過阻止eIF1A和TC復合物的結合來抑製43S PIC的進一步組裝🏃♂️➡️。此外🤵♀️,他們還發現了PDCD4的C端MA3結構域與mRNA進入位點上方的一個eIF4A結合,從而使eIF4A處於抑製狀態,進而抑製了eIF4F復合物的組裝。最後通過點突變驗證,研究人員進一步驗證了這些關鍵結合區域和作用機製。
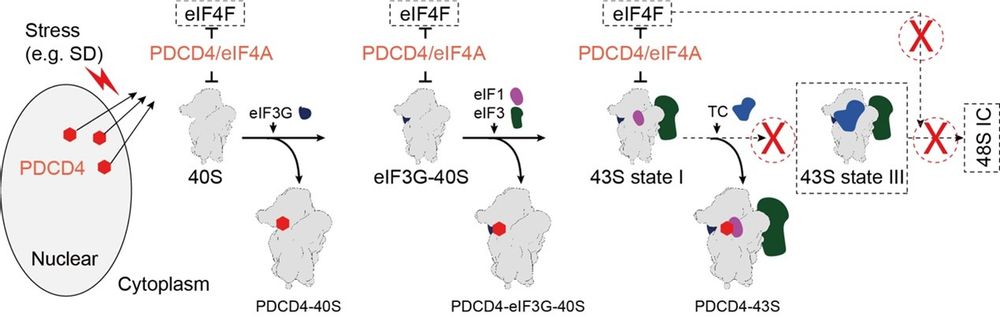
基於這些發現,研究人員提出了PDCD4在抑製翻譯起始中的功能模型🧟♀️。在這一模型中🧝♀️,PDCD4通過其RBR結構域占據40S核糖體的mRNA進入通道,從而阻止起始復合物的形成。總的來說,這項研究為我們理解蛋白質翻譯調控的機製提供了新的視角,對於深入探究細胞內生物學過程的調控機製以及相關疾病的發生和發展具有重要意義🙀。
該研究的共同第一作者為MK体育平台生物醫學研究院博士研究生葉顯雯和黃子軒,通訊作者為程凈東研究員👨🏼⚕️。程凈東課題組依托MK体育平台生物醫學研究院和附屬閔行醫院🍎,長期致力於翻譯調控的分子機製研究👙。
原文鏈接🧑🏼🦲:https://www.nature.com/articles/s41422-024-00962-z