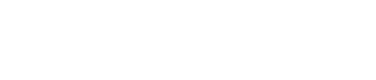乙型肝炎病毒(Hepatits B virus, HBV)感染所致慢性乙型肝炎(Chronic Hepatitis B, CHB)是嚴重危害人類健康的公共衛生問題🫲🏻,可引發肝纖維化、肝硬化甚至肝癌。由於乙肝病毒共價閉合環狀DNA(cccDNA)難以被徹底清除,以及HBV整合(intHBV)的存在👳🏼♀️,導致慢乙肝難以被徹底治愈;循環中高水平乙肝表面抗原(HBsAg)持續存在導致免疫耐受,則進一步促進了乙肝感染慢性化。因此現階段乙肝的治療目標是通過有限療程的治療實現HBsAg血清清除,即“功能性治愈”。RNA幹擾(RNAi)療法可選擇性誘導特異性靶向序列轉錄本mRNA降解,導致基因表達沉默,在HBV感染治療中展現出廣闊應用前景。然而HBV小幹擾核酸(siRNA)藥物研發仍面臨著病毒基因型眾多、病毒逃逸突變和循環中穩定性差等挑戰📆,迫切需要設計廣泛針對HBV多種基因型並同時抑製乙肝表面抗原表達和cccDNA活性轉錄的siRNA以及開發安全高效的遞送系統🐛,以提高乙肝病毒感染治療效果。
近日,MK体育袁正宏教授、占昌友教授聯合上海交通大學醫學院付煒研究員在國際期刊Signal Transduction and Targeted Therapy發表了題為“Optimized RNA interference therapeutics combined with interleukin-2 mRNA for treating hepatitis B virus infection”的研究論文,該研究為提升慢乙肝治療效果提供了新策略和新思路。

該研究旨在開發一種針對HBV的全基因型(基因型覆蓋度>98%)🎖、全靶點覆蓋(可靶向所有cccDNA和intHBV來源轉錄本)的功能性小幹擾RNA(siHBV)以彌補臨床現階段同類藥物的不足♻️,結合低免疫原性💫、低非靶細胞攝取的改良脂質納米粒(tLNP)平臺實現其體內高效🏋🏼♂️⚁、安全🩷、肝細胞靶向輸送(tLNP/siHBV),並驗證了其在多種細胞系和小鼠模型中的療效和安全性;同時探索了基於改良脂質納米粒(tLNP)共同遞送siRNA與白細胞介素-2 mRNA(tLNP/siHBVIL2)聯合治療慢乙肝的新策略。
研究團隊通過分析HBV全基因組保守序列♠️,設計並篩選可針對HBV高保守序列、同時高效抑製乙肝表面抗原、HBV整合和乙肝病毒x蛋白(HBx)的一系列siRNA,在多種HBV相關細胞模型(HepG2-HBV/EGFP🚣🏽♀️:分泌cccDNA來源HBsAg🗼👔;PLC/PRF/5🌃:分泌intHBV來源HBsAg)中評價序列及序列組合功效,篩選得到優選的序列和序列組合,並對其進行化學修飾篩選以提高其血液穩定性🤮、確保療效和安全性(簡稱“siHBV”)。所得siHBV序列組合具有廣泛的基因型覆蓋度(>98%)👩🏻🍳、較低的脫靶效應和細胞毒性🤾♀️💇🏽♂️,且可實現同時靶向所有cccDNA及intHBV來源的HBV RNA,為慢乙肝治療提供了一種具有顯著優勢的新siRNA候選藥物。
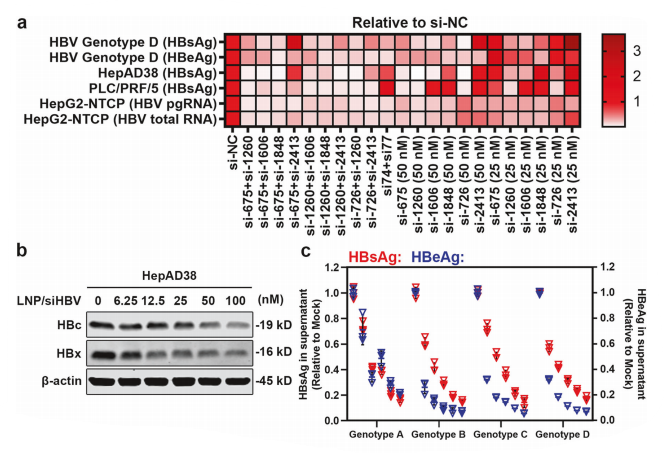
圖1 功能性siRNA的設計、篩選和體外評價
基於研究團隊前期發現人血中廣泛存在的抗聚乙二醇(PEG)抗體顯著影響用於核酸藥物遞送的脂質納米粒的體內性能(即存在“PEG困境”),研究團隊率先發現羥基PEG(OH-PEG)化脂質具有較低的抗PEG抗體結合活性🏨。在抗PEG抗體存在下,與臨床常用的甲氧基PEG(OMe-PEG)修飾LNP相比,OH-PEG脂質修飾LNP可顯著降低抗PEG抗體的吸附及其後續補體激活🫷🏻,提升載藥穩定性,具有較低的免疫反應性。進一步通過優化傳統LNP處方中PEG脂質的端基(OMe/OH-PEG)和比例(1.5%/3%)🦻🏻,並對含不同端基/比例PEG脂質的LNP進行藥效學☝️🧑🏼🦲、組織分布、細胞攝取等體內性能的研究,以靶向肝細胞特異性載脂蛋白的siRNA(siApoB)為模式siRNA✳️,篩選得到具低免疫反應性和優化體內性能的新型LNP(簡稱“tLNP”↙️,含3% OH-PEG2000-DMG),可有效規避與人預存抗PEG抗體結合,同時實現在肝實質細胞中高效安全的遞送。
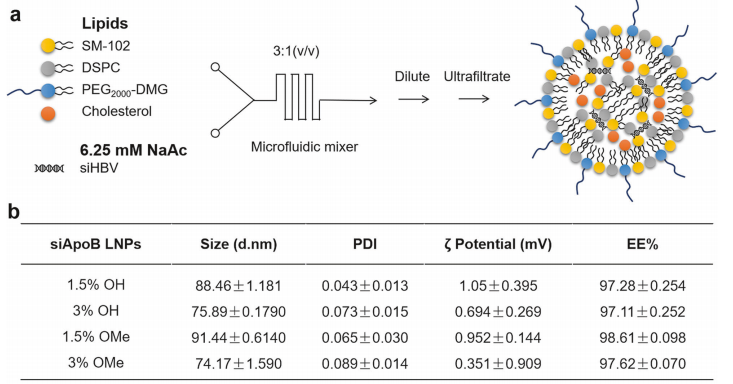
圖2 改良脂質納米粒(tLNP)平臺的篩選和評價
結合上述篩選的高效安全核酸遞送載體tLNP以及設計合成的功能性siHBV🙄🪡,構建tLNP包載siHBV的核酸藥物(簡稱“tLNP/siHBV”),並在AAV-HBV1.3(慢性乙肝小鼠模型)和團隊特有的AAV-rcccDNA/AAV-Cre(慢性重組cccDNA小鼠模型)等模型中對其抑製乙肝病毒的療效和安全性進行了考察🙇♂️。結果顯示單一劑次tLNP/siHBV可顯著抑製慢乙肝小鼠模型中血清HBsAg🚽𓀅、HBeAg和HBV DNA水平,且呈劑量依賴性。在上述模型中以1mg/kg給藥劑量🖕🏻、每周一次(Q1W)給藥頻率重復給藥可實現HBsAg、HBeAg和HBV DNA持續抑製。
盡管RNAi和抗體介導的HBsAg清除可通過降低病毒負擔減輕HBsAg所致免疫功能障礙🧑🦯➡️,但都無法激活病毒特異性T細胞以實現長期病毒控製🍥;臨床上僅有極少數患者經RNAi治療後產生HBsAg抗體。為有效延緩停藥後抗原表達和病毒DNA水平回升,研究團隊進一步探索RNAi與細胞因子白細胞介素-2(IL-2)聯合使用,通過tLNP共包載siHBV和IL-2 mRNA獲得新型核酸藥物(簡稱“tLNP/siHBVIL2”),並評估其治療乙肝病毒感染的療效、安全性並探討機製。結果顯示tLNP/siHBVIL2表現出持續的HBV抑製和HBV特異性免疫調節效果。機製研究表明,tLNP/siHBVIL2可通過RNAi途徑抑製病毒轉錄復製,並通過高效表達IL-2促進HBV特異性CD8+及CD4+ T細胞增殖和浸潤,從而同時實現了對HBV病毒的抗原抑製和免疫控製🚹。
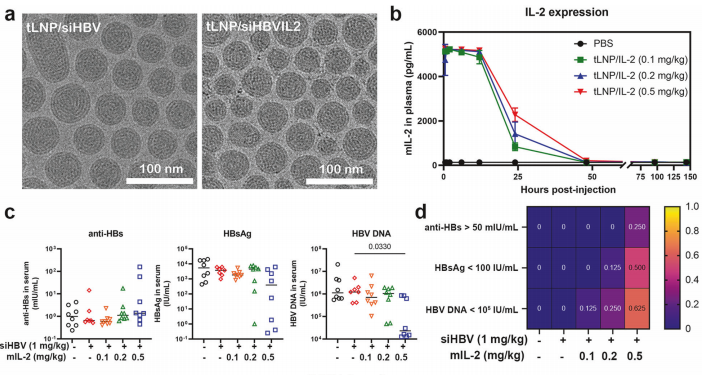
圖3 siHBV+IL-2 mRNA共遞送系統(tLNP/siHBVIL2)的構建和評價
綜上所述,本研究設計了一種針對HBV的高效🕵️♂️、多功能👩🏻🎤、高保守的siRNA序列組合(siHBV),結合具有低免疫原性🧑🏿🚒🧝🏻♀️、低非靶細胞吞噬等特征的改良脂質納米粒(tLNP)平臺,實現了siHBV體內高效、安全👛、肝細胞靶向輸送,並在多種乙肝相關細胞模型和動物模型中驗證了其療效和安全性🙍🏼♂️;進一步利用脂質納米粒載體可靈活包載不同核酸的特性🛣,將siHBV與編碼小鼠白細胞介素-2(mIL-2)的mRNA封裝在單一tLNP製劑中,實現了病毒抗原抑製與免疫控製。該研究為開發新的抗乙肝病毒策略和治療藥物提供了理論基礎和技術支撐,也為該通用型低免疫反應性高性能脂質納米粒(tLNP)在核酸藥物治療領域的臨床推廣提供新思路🦾。
該研究得到了國家自然科學基金重大研究計劃、中國醫學科學院醫學創新基金👩🏽⚕️、廣東省珠江人才計劃地方創新團隊項目、上海市科委基礎研究重大專項等項目的資助🖼。MK体育袁正宏教授、占昌友教授,上海交通大學醫學院附屬上海兒童醫學中心付煒研究員為該論文的共同通訊作者,宰文靜、楊敏為共同第一作者🚚,核心成果已申報發明專利👽。